Teoriilmukimia - Hukum-hukum gas ideal diantaranya
Hukum boyle, Hukum Charles, Hukum Gay lussac. Teori kinetik gas memberikan
jembatan antara tinjauan gas secara mikroskopik dan makrokospik. Hukum-hukum
gas seperti hukum Boyle, Charles, dan Gay Lussac, menunjukkan hubungan antara
besaran-besaran makrokospik dari berbagai macam proses serta perumusannya. Kata
kinetik berasal dari adanya anggapan bahwa molekul-molekul gas selalu bergerak.
1. Hukum Boyle
Pada abad ketujuh belas, Robert Boyle, seorang
fisikawan dari Inggris, mempelajari perilaku gas secara sistematis dan
kuantitatif. Robert Boyle melakukan penelitian mengenai hubungan antara tekanan
terhadap volume dari sampel gas. Hasil percobaan Boyle menyatakan bahwa
Tekanan dari Sejumlah
Tetap Suatu Gas Pada Suhu yang Dijaga Konstan adalah Berbanding Terbalik dengan
Volumenya.
Sehingga dapat diperoleh persamaan sebagai
berikut.
p1V1 = p2V2
Keterangan:
p1 : tekanan
gas pada keadaan 1 (N/m2)
p2 : tekanan
gas pada keadaan 2 (N/m2)
V1 : volume
gas pada keadaan 1 (m3)
V2 : volume
gas pada keadaan 2 (m3) |
Grafik 1. Hubungan volume dan tekanan gas pada
suhu konstan (Isotermal).
|
Jika dibuat grafik, maka akan menghasilkan
sebuah kurva yang disebut kurva isotermal. Perhatikan gambar diatas. Kurva
isotermal merupakan kurva yang bersuhu sama.
Hukum Charles dikemukakan oleh fisikawan
Prancis bernama Jacques Charles. Charles menyatakan.
Bahwa Jika Tekanan Gas
yang Berada dalam Bejana Tertutup Dipertahankan Konstan, Maka Volume Gas
Sebanding Dengan Suhu Mutlaknya
Sehingga diperoleh persamaan sebagai berikut,
Keterangan:
V1 : volume
gas pada keadaan 1 (m3)
V2 : volume
gas pada keadaan 2 (m3)
T1 : suhu
mutlak gas pada keadaan 1 (K)
T2 : suhu
mutlak gas pada keadaan 2 (K)
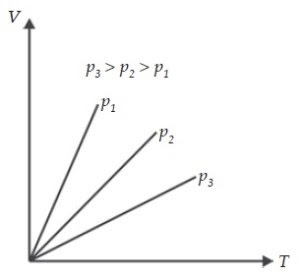 |
Grafik 2 Hubungan volume dan suhu gas pada
tekanan konstan (Isobarik)
|
Apabila hubungan antara volume dan suhu pada
hukum Charles kita lukiskan dalam grafik, maka hasilnya tampak seperti pada
gambar diatas. Kurva yang terjadi disebut kurva isobarik yang artinya bertekanan
sama.
3. Hukum Gay Lussac
Hukum Gay Lussac dikemukakan oleh kimiawan
Perancis bernama Joseph Gay Iussac. Gay Lussac menyatakan
Bahwa Jika Volume Gas yang
Berada dalam Bejana Tertutup Dipertahankan Konstan, Maka Tekanan Gas Sebanding
Dengan Suhu Mutlaknya
Sehingga diperoleh persamaan sebagai berikut,
Keterangan:
T1 : suhu
mutlak gas pada keadaan 1 (K)
T2 : suhu
mutlak gas pada keadaan 2 (K)
p1 : tekanan
gas pada keadaan 1 (N/m2)
p2 : tekanan
gas pada keadaan 2 (N/m2)
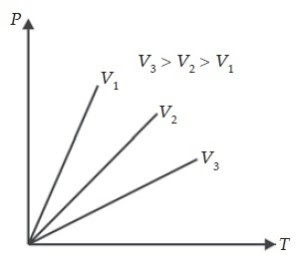 |
Grafik 3 Hubungan tekanan dan suhu gas pada
volume konstan (Isokhorik)
|
Apabila hubungan antara tekanan dan suhu gas
pada hukum Gay Lussac dilukiskan dalam grafik, maka hasilnya tampak seperti
pada gambar diatas. Kurva yang terjadi disebut kurva isokhorik yang
artinya volume sama.
3. Hukum Boyle-Gay Lussac
Apabila hukum Boyle, hukum
Charles, dan hukum Gay Lussac digabungkan, maka diperoleh persamaan sebagai
berikut.
Persamaan di atas disebut hukum Boyle-Gay
Lussac. Kita telah mempelajari hukum-hukum tentang gas, yaitu hukum Boyle,
Charles, dan Gay Lussac. Namun, dalam setiap penyelesaian soal biasanya
menggunakan hukum Boyle-Gay Lussac. Hal ini disebabkan hukum ini merupakan
gabungan setiap kondisi yang berlaku pada hukum-hukum gas ideal.



jadi bisa belajar banyak di blog ini
BalasHapusberita tinju terbaru
mantap
BalasHapus